Podrían abrir un camino de optimización de las terapias contra el Parkinson
El estudio de un equipo del CONICET y colegas de una universidad francesa fue publicado en la revista especializada npj Parkinson’s Disease, del grupo Nature.

El Parkinson es una enfermedad neurodegenerativa crónica, caracterizada principalmente por trastornos de movimiento. Sus síntomas más frecuentes son los temblores, la rigidez muscular, la lentitud de movimientos y los problemas de equilibrio o postura. Su causa es la muerte progresiva de las neuronas responsables de producir dopamina, un neurotransmisor fundamental para procesos como el control del movimiento, la memoria, la recompensa cerebral y el aprendizaje, entre otros. Aunque puede aparecer en edades más tempranas, afecta principalmente a personas mayores de 60 años y es la segunda enfermedad neurodegenerativa más frecuente después del Alzheimer.
La terapia más frecuente y efectiva para tratar el Parkinson es la administración de levodopa (L-Dopa), un fármaco que el cerebro puede transformar en dopamina. El desarrollo de este fármaco a fines de la década del 60’ marcó un hito en la historia de la medicina y permitió mejorar la vida de los pacientes al facilitarles recuperar funciones motoras que antes se consideraban perdidas. Aunque la L-Dopa es considerado el tratamiento “estándar” para el Parkinson, luego de su administración prolongada pueden aparecer efectos secundarios, como disquinesias (movimientos repetitivos erráticos que el paciente no puede controlar), fluctuaciones en la respuesta al medicamento o incluso ciertos síntomas cognitivos y emocionales. Comprender mejor las razones de estos efectos no deseados es importante para optimizar las terapias vigentes.
Un reciente estudio realizado por un equipo de investigación del CONICET en el Centro de Investigaciones en Química Biológica de Córdoba (CIQUIBIC, CONICET-UNC) y un laboratorio de la Universidad Grenoble Alpes (Francia) reveló que L-Dopa además de cumplir su rol terapéutico clásico interactúa con la estructura interna de las neuronas de una manera hasta ahora desconocida, generando alteraciones que podrían ser una de las causas de los efectos adversos que suelen aparecer después de muchos años de tratamiento. El estudio fue publicado en la revista especializada npj Parkinson’s Disease, del grupo Nature.
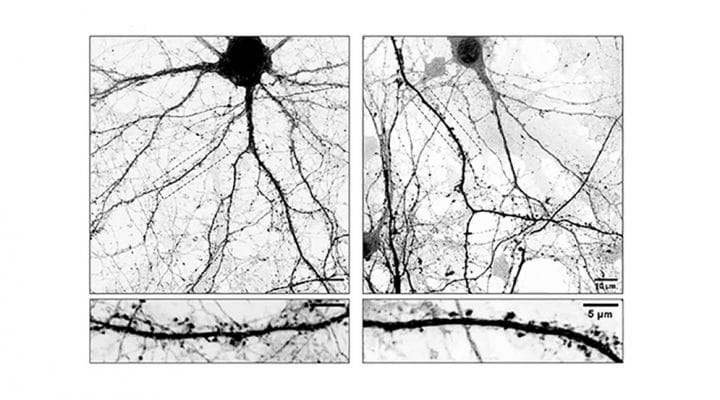
A través de diversos ensayos los equipos científicos descubrieron que L-Dopa puede incorporarse a los microtúbulos que forman parte del esqueleto interno de las neuronas. Estos microtúbulos funcionan como “rieles” microscópicos que permiten el movimiento interno de sustancias esenciales y tienen un papel crucial en el mantenimiento de la conexión entre las neuronas (sinapsis). “El problema es que cuando L-Dopa se integra en estos microtúbulos los hace menos dinámicos afectando su ingreso a las espinas dendríticas, estructuras que funcionan como las ‘antenas’ receptoras de la neurona donde se forman las sinapsis. Como consecuencia directa de esto, las neuronas comienzan a perder espinas, claves para la comunicación neuronal. Entendemos que esta inestabilidad sináptica podría explicar algunas de las complicaciones que aparecen luego de un tiempo prolongado de tomar L-Dopa”, señala Gastón Bisig, investigador del CONICET en el CIQUIBIC y uno de los líderes del estudio.
Los ensayos
Para poder comprobar esta hipótesis, los investigadores utilizaron como modelo de estudio cultivos primarios de neuronas; células nerviosas que se obtienen de una región específica del cerebro de un ratón y que se cultivan en el laboratorio bajo condiciones controladas que les permiten madurar y desarrollarse como lo harían en el cerebro. Estas células fueron tratadas con L-Dopa y mediante microscopios de alta resolución se analizó cómo cambiaba la forma y la cantidad de espinas dendríticas. En el marco de estos experimentos, también realizaron tinciones específicas con moléculas fluorescentes que les permitieron visualizar estructuras internas de las células. Así pudieron ver en tiempo real la dinámica de los microtúbulos dentro de las neuronas, es decir, cómo los “rieles” crecen, se acortan y se mueven. Además, trabajaron con neuronas modificadas genéticamente que no poseen ciertas enzimas esenciales para que la L-Dopa se incorpore en los microtúbulos; lo que permitió demostrar que los efectos negativos suceden solo cuando esta incorporación realmente ocurre.
“Por otra parte, realizamos estudios bioquímicos complementarios en ‘tubos de ensayo’, donde armamos microtúbulos purificados enriquecidos en L-Dopa. Este sistema artificial nos permitió evaluar reacciones que ocurren en el interior de las células, pero en un entorno controlado. De esta forma, pudimos comprobar que, una vez que la L-Dopa se incorpora en los microtúbulos, las enzimas naturales de la célula no logran removerla, lo que sugiere que este cambio puede persistir en el tiempo”, afirma la primera autora del estudio Agustina Zorginotti, quien hoy trabaja en la Universidad Grenoble Alpes e hizo su doctorado en el CIQUIBIC con una beca del CONICET bajo la dirección de Bisig.
La posibilidad de nuevas estrategias terapéuticas futuras
De acuerdo con Bisig y Zorginotti, si bien no hay dudas que L-Dopa sigue siendo una herramienta indispensable para el tratamiento de los síntomas motores del Parkinson, los resultados de su estudio abren la puerta a una reflexión importante sobre su uso prolongado. “Si la L-Dopa modifica los microtúbulos de manera estable y produce una pérdida progresiva de espinas dendríticas y sinapsis, esto podría contribuir a varios de los problemas que aparecen con los años. Comprender este mecanismo brinda una posible explicación estructural para esos efectos”, afirma Bisig.
Asimismo, ambos destacan que los hallazgos realizados abren la posibilidad de desarrollar nuevas estrategias terapéuticas que apunten a proteger los microtúbulos o impedir que la L-Dopa se incorpore en ellos. “Incluso podrían inspirar el diseño de tratamientos complementarios que mantengan la plasticidad sináptica y reduzcan la vulnerabilidad de las neuronas al deterioro. En conjunto, nuestros resultados invitan a pensar la terapia del Parkinson de una manera más integral, considerando no solo la química del neurotransmisor sino también la salud estructural de las conexiones neuronales”, agrega Zorginotti.
Bisig destaca que este trabajo fue realmente un esfuerzo conjunto entre el equipo del CIQUIBIC y el laboratorio de la universidad francesa, a cargo de la investigadora argentina Leticia Peris, en el que Zorginotti tuvo un rol central como nexo. Una parte de los experimentos se realizó en Argentina cuando la joven científica realizaba su doctorado y otra parte se llevó a cabo en Francia durante las dos estadías de investigación que realizó allí para completar su tesis. Más tarde, ya en su etapa posdoctoral en el grupo de la Peris, pudo continuar y profundizar estas líneas de estudio.
“Gracias a este ida y vuelta constante se integraron dos enfoques complementarios. Desde Argentina aportamos experiencia en estudios in vitro y en cultivos neuronales, mientras que el equipo francés sumó su especialización en dinámica de espinas dendríticas y en el uso de modelos animales modificados para las enzimas que incorporan L-Dopa en microtúbulos. Esta articulación permitió avanzar con mayor rapidez y, sobre todo, con una mirada más amplia y completa de la que podría haber logrado cualquiera de los laboratorios trabajando por separado”, afirma Bisig.
Para finalizar, Zorginotti señala que más allá de la parte experimental, en una investigación de este tipo hay una gran cantidad de tareas que no siempre se ven, que van desde la planificación de los experimentos, el análisis y la discusión de los resultados, hasta la redacción del manuscrito y las revisiones. “Poder contar con un equipo en el que cada parte aporta su experiencia y perspectiva para alcanzar un objetivo en común hizo que el proyecto fuera mucho más completo”, concluye.